Stavba atómu
Stavba atómu
Atóm (grec. άτομον – nedeliteľný) je najmenšia, chremicky ďalej nedeliteľná častica chemického prvku. , ktorá je nositeľom jeho vlastností. Skladá sa z jadra a obalu. V jadre atómu sú protóny a neutróny, v obale sú elektróny (usporiadané vo vrstvách).
Tento pojem atómu zaviedli grécki filozofi Leuikippos z Milétu a Démokritos z Abdér cca pred 2500 rokmi , všeobecne sa ujal až na začiatku 19. storočia.
neskôr Platón a Aristoteles vytvorili predsavu, že látkové telesá sú úplne súvislé a nedajú sa deliť na neustále menšie častice.
V polovici 17. storočia sa rozvojom fyziky a chémie znova objavuje atómová hypotéza. Jej zástancami boli Newton a Lomonosov, ktorí na jej základe založili kinetický teóriu látky.
1834 M. Faraday objavil, že elektrina sa skladá zo základných ďalej nedeliteľných častí
na konci 19. storočia J.J. Thomson dokázal, že nositeľmi elementárneho náboja sú hmotné častice nazývané elektróny. E Rutherford predpokladal, že elektróny obiehajú okolo jadra po kružniciach.
1913 N. Bohr navrhol model atómu, v ktorom elektróny obiehajú okolo jadra v kružniciach s určitým polomerom. ak elektrón obieha po niektorej z ¸¸dovolených´´ dráh má stálu energiu. Zmena jeho energie môže nastať iba pri prechode z jednej vrstvy do druhej.
v 20. storočí sa dokázalo, že nioektroré dráhy elektrónov nie sú kruhové, ale elipsovité, prípadne ešte zložitejšie.
Ernest Rutherford a Niels Bohr objavili subatomárne častice a tým sa dokázalo, že atóm nie je nedeliteľný. Atómy sa ďalej zlučujú do molekúl. V prirodzenom prostredí majú rovnaký počet elektrónov aj protónov, v tomto stave je atóm elektroneutrálny. Ak sa tento pomer zmení, vzniká ión, ktorý je buď kladný (katión) alebo záporný (anión). Molekula, atóm či dokonca jeho subatomárne častice sú v neustálom pohybe.
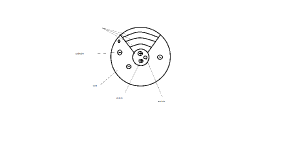 bohrov model atómu
bohrov model atómu
Atóm podľa Demokrita
Atóm je jednotlivá častica uzavretá v sebe, nedeliteľná a plná, oddelená akýmsi prázdnom, čiže nebytím od každej inej jednotlivej častice. Z týchto jednotlivých častí sa skladá celá pozorovateľná skutočnosť, ale ony samy sú postihnuteľné len prostredníctvom rozumového poznania. Atóm je bytím nevznikajúcim ani nehynúcim, je čímsi obsahom rovnorodým. Atómy sa líšia iba podobou a veľkosťou. Nepodlieha kvalitatívnym zmenám, ale len kvantitatívnym zmenám. Atóm má tri základné vlastnosti: tvar, polohu a miesto.
Atóm podľa Diderota
Atóm je entita, z ktorej pozostáva svet i veci v ňom. Každý atóm prejavuje sily príťažlivosti, pohyb a schopnosť pociťovať: je to akási zmaterializovaná Leibnizova monáda. Každý atóm sa kvalitatívne líši od každého iného atómu. Každý atóm má päť odlíšiteľných vlastností: pohyb, dĺžku, výšku, nepriestupnosť a citlivosť.
Vzájomnou výmenou prvkov a ich vlastností vzniká rôznorodosť vecí a javov vo svete, a to prechodom zo stavu driemajúcej citlivosti v atómoch až do stavu jej maximálneho rozvoja v podobe ľudského rozumu
Kinetická teória látok
Kinetická teória látok sa zakladá na týchto poznatkoch:
1. Látky akéhokoľvek skupentva sa skladajú z častíc (molekúl, atómov, iónov), pričom priestor, ktorý teleso z danej látky zaberá, nie je vyplnený úplne - ide o nespojitú (diskrétnu) štruktúru.
2. Častice sa v látkach pohybujú, ich pohyb je ustavičný a neusporiadaný (chaotický) - častice sa v látke pohybujú rýchlosťami rôznych smerov a veľkostí - tepelný pohyb.
3. Častice na seba navzájom pôsobia príťažlivými a zároveň odpudivými silami. Veľkosť týchto síl závisí od vzdialenosti časticami.
Dôkazy neusporiadaného pohybu častíc v látkach:
1. Difúzia
- samovoľné prenikanie častíc jednej látky medzi častice druhej látky, spôsobené iba vlastným pohybom molekúl (hypermangán vo vode, prchanie naftalínu)
- závislosť priebehu difúzie od teploty je priamo úmerná, to znamená, že s teplotou sa zvyšuje rýchlosť difúzie
2. tlak plynu
- spôsobený narážaním molekúl na steny nádoby
- javí sa ako spojitá veličina
- pohyb molekúl plynu je chaotický, počet molekúl, ktoré narazili na stenu, kolíše, ukážka java aplet
- meriame ho manometrom
3. Brownov pohyb
Atómová teória
Atómová teória, taktiež nazývaná Daltonova teória podľa objaviteľa Johna Daltona
Začiatkom 19. storočia sa Dalton zaoberal rozborom chemických látok a pozorovaním chemických reakcií. Svoje závery spísal do troch zákonov:
-
Všetky látky sa skladajú z veľmi malých, nedeliteľných častíc – atómov. Atómy toho istého prvku sú rovnaké, atómy rôznych prvkov sú rôzne a líšia sa svojimi vlastnosťami.
-
Počas chemickej reakcie nastáva vzájomné spájanie, oddeľovanie a preskupovanie atómov. Počas chemickej reakcie atómy nevznikajú, nezanikajú a nemenia sa na atómy iného prvku.
-
Ak dva prvky tvoria navzájom niekoľko zlúčenín, hmotnosti jedného prvku pripadajúce v nich na jednu a tú istú hmotnosť druhého prvku sú v pomere malých celých čísel.
| Objaviteľ (rok) | Hmotnosť (kg) | Náboj (veľkosť náboja) (C) | Symbol | |
|---|---|---|---|---|
| protón | Ernest Rutherford | 1,6729×10−27 | kladný (1,60210 × 10−19) | p+, H+ |
| neutrón | James Chadwick | 1,6749×10−27 | bez náboja | n |
| elektrón | Joseph John Thomson | 9,1091 x 10−31 | záporný (1,60210 × 10−19) | e- |
Samotné protóny a neutróny nie sú elementárnymi časťami – skladajú sa z „elementárnejších“ kvarkov.
Skladba atómu
- jadro
- protóny
- neutróny
- obal
- elektóny
Podľa protónového čísla Z sú prvky zoradené do periodickej tabuľky.
Počet neutrónov v jadrách toho istého prvku môže byť odlišný. Súhrnný počet protónov a neutrónov vyjadruje nukleónové číslo (A). Označuje sa horným indexom pred značkou prvku (napríklad 238U alebo 12C). Pri ľahších prvkoch je pomer protónov a neutrónov približne vyrovnaný, pri ťažších prvkoch je viac neutrónov ak protónov. .
Rozdiel A−Z zodpovedá počtu neutrónov. Vyjadruje ho neutrónové číslo N.
podľa rozdielov týchto čísiel látky rozdeľujeme na
- izotopy ako nuklidy s rovnakým protónovým číslom, ale odlišným počtom neutrónov (inými slovami: rôzne nuklidy toho istého chemického prvku),
- izotóny ako nuklidy s rovnakým neutrónovým číslom,
- izobary ako nuklidy s rovnakým nukleónovým číslom.
- nuklidy látka, ktorej atómy majú rovnaké protónové a nukleónové číslo
V elektrónovom obale prebiehajú procesy, ktoré sa navonok prejavujú ako chemické reakcie, kedy sa mení iba usporiadanie elektrónového obalu a atómové jadro zostáva nezmenené. S pohybom každej hmotnej častice ja nerozlučne spojené vlnenie. Preto sa hmotná častica nepohybuje – ako by sa predpokladalo – určitou rýchlosťou po určitej dráhe, ale sa v istom okamihu vyskytuje s určitou pravdepodobnosťou v uvažovanom mieste. Čím menšia je častica, a čím rýchlejšie sa pohybuje, tým viac prevláda vlnový charakter.
Elektrónový obal je teda určitá časť priestoru okolo jadra. Tvorí teda obal jadra, ktorý je asi 100 000krát väčší ako jadro a nachádzajú sa v ňom záporne nabité elektróny.
Orbitál
(latinský pôvod – orbis kruh)
Je oblasť najpravdepodobnejšieho výskytu elektrónu okolo jadra. V orbitáloch sa elektróny vyskytujú s 95-99% pravdepodobnosťou. Ich stavy a energiu charakterizujú tri kvantové čísla.
Hlavné kvantové číslo n – určuje energiu elektrónu v atóme a nadobúda hodnoty 1 až nekonečno, elektróny s rovnakým hlavným kvantovým číslom tvoria elektrónovú vrstvu, jednotlivé elektrónové vrstvy sa označujú číslicami 1,2,3,4,5,6,7... podľa rastúceho n alebo sa značia K,L,M,N,O,P,Q.
Vedľajšie kvantové číslo l – určuje tvar a energiu orbitálu a nadobúda hodnoty od 0 do
n – 1(iba celé čísla), hodnoty vedľajšieho kvantového čísla sa označujú určitým písmenom, písmená sa píšu za hlavne kvantové číslo.
Magnetické kvantové číslo m – určuje orientáciu orbitálu v priestore a nadobúda hodnoty od –l do +l vrátane 0 iba celé čísla.
Tvar orbitálov označujeme malými písmenami s, p, d, f. Je vyjadrený trojrozmernými modelmi.
s – je guľovo symetrický
p – má činkovitý tvar a orientuje sa tromi rôznymi spôsobmi vždy v smere súradnicových osí ako px, py, pz.
d – orbitál možno prirovnať k dvom skríženým činkám v štyroch rôznych priestorových polohách, má 5 možných priestorových orientácii.
f – je tvarovo najzložitejší, má 7 možných tvarových orientácii
Degenerované orbitály - sú orbitály s rovnakou energiu, t.j. s rovnakým hlavným a vedľajším kvantovým číslom.
Spinové kvantové číslo s – charakterizuje rotáciu elektrónu okolo vlastnej osi a môže mať hodnoty +1/2 a -1/2. mierou rotácie elektrónu je rotačný impulz nazývaný spin.
Elektrónová konfigurácia atómu – ukazuje obsadenie atómových orbitálov elektrónmi. Znázorňujeme ich rámčekovými diagramami kde elektróny označujeme šípkami. Opačný smer šípok znamená, že elektróny majú opačný spin.
Postupné obsadzovanie orbitálov sa riadi troma pravidlami:
Výstavbový princíp – orbitály s nižšou energiou sa zapĺňajú elektrónmi skôr než orbitály s vyššou energiou, najskôr sa zapĺňajú orbitály s menším súčtom n+l, v prípade rovnosti súčtu sa obsadzujú najprv s menším n, tomu zodpovedá poradie 1s,2s,2p,3s,3p,...5d,6p.
Pauliho princíp – v atóme nemôžu existovať elektróny, ktoré by mali všetky štyri kvantové čísla rovnaké. Musia sa líšiť aspoň jedným, a to spinovým;v každom orbitále môžu byť najviac dva elektróny, a preto: na hladine s sú najviac dva elektróny
– na hladine p je najviac šesť elektrónov
– na hladine d je najviac desať elektrónov
– na hladine f je najviac štrnásť elektrónov
Hundovo pravidlo – pre elektróny v orbitáloch platí, že elektrónové parý vznikajú až po obsadení orbitálu s rovnakou energiou jedným elektrónom a nespárené elektróny maju rovnaký spin. Hundovo pravidlo určuje rozmiestnenie a spin elektrónov v orbitáloch, ktoré majú rovnakú energiu, majú teda rovnaké hlavné a vedľajšie číslo.